Il meccanismo di coagulazione del sangue è un processo che trasforma il sangue da un liquido in un solido e coinvolge diversi fattori di coagulazione diversi. Il meccanismo genera fibrina quando viene attivata, che, insieme al tappo piastrinico, arresta l’emorragia.
Quando mancano fattori di coagulazione, il sangue non si coagula correttamente e il sanguinamento continua.
I pazienti con emofilia A o B hanno un difetto genetico che si traduce in una carenza di uno dei fattori di coagulazione del sangue.
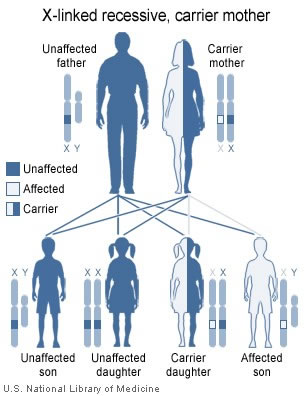
La regina Vittoria era una portatrice e passò la mutazione a suo figlio Leopoldo e attraverso molte delle sue figlie ai membri delle famiglie reali di Spagna, Russia e Germania.
Emofilia A ed emofilia B
Esistono due tipi principali di emofilia: emofilia A (a causa della carenza di fattore VIII) e emofilia B (a causa della carenza di fattore IX). Sono clinicamente quasi identici e sono associati a sanguinamento spontaneo in articolazioni e muscoli e sanguinamento interno o esterno dopo un infortunio o un intervento chirurgico.
Dopo ripetuti episodi di sanguinamento possono essere causati danni permanenti alle articolazioni e ai muscoli che sono stati colpiti, in particolare a caviglie, ginocchia e gomiti.
Approssimativamente 1 su 5.000 maschi nasce con Emofilia A e 1 su 30.000 maschi nasce con Emofilia B. L’emofilia colpisce persone di tutte le razze e origini etniche a livello globale. Le condizioni sono entrambe legate all’X e praticamente tutti i malati di emofilia sono maschi. Anche i portatori femminili possono sanguinare in modo anomalo, perché alcuni hanno bassi livelli del fattore di coagulazione rilevante.
Le persone con emofilia hanno una mutazione genetica nel gene affetto sul cromosoma X, che si traduce in una ridotta produzione del Fattore VIII o IX e crea una tendenza al sanguinamento, perché la coagulazione richiede molto più tempo del normale, rendendo così il coagulo debole e instabile
Circa un terzo dei pazienti con emofilia non ha storia familiare della malattia, sia a causa di nuove mutazioni genetiche, sia perché le precedenti generazioni affette hanno avuto figlie (che erano portatrici) o figli che sono morti nella prima infanzia dall’emofilia o da qualsiasi altra causa o che non sono stati colpiti
Emofilia acquisita
Questo è molto raro. Il paziente sviluppa la condizione durante la sua vita e non ha una causa genetica o ereditaria. Si manifesta quando il corpo forma anticorpi che attaccano uno o più fattori di coagulazione del sangue (solitamente il fattore VIII), impedendo così il corretto funzionamento del meccanismo di coagulazione del sangue. I pazienti possono essere maschi o femmine e il pattern di sanguinamento è piuttosto diverso da quello dell’emofilia classica, le articolazioni sono raramente colpite. Il disturbo è particolarmente associato alla vecchiaia e occasionalmente complica la gravidanza.
Cause dell’emofilia
Le persone con emofilia nascono con esso. È causato da un difetto in uno dei geni che determina come il corpo compia il fattore VIII o IX della coagulazione del sangue. Questi geni si trovano sul cromosoma X.
Per capire come viene ereditata l’emofilia, è importante conoscere i cromosomi.
Cosa sono i cromosomi?
I cromosomi sono blocchi di DNA (acido desossiribonucleico). Contengono istruzioni molto dettagliate e specifiche che determinano:
- Come si sviluppano le cellule del corpo di un bambino.
- Quali caratteristiche avrà il bambino, incluso, ad esempio, i capelli e il colore degli occhi.
- Se il bambino è maschio o femmina.
Nell’uomo ci sono 23 paia di cromosomi, inclusa la coppia del cromosoma sessuale. Esistono due tipi di cromosoma sessuale:
- Il cromosoma X.
- Il cromosoma Y.
Tutti gli umani hanno una coppia di cromosomi sessuali:
-
- I maschi hanno una coppia X + Y
- Le femmine hanno una X + X coppia
NB Le femmine non hanno cromosomi Y.Quali cromosomi ereditiamo dai nostri genitori?
Come possiamo calcolare il rischio di emofilia nella prole?
(Prima di continuare a leggere, ricorda che il gene difettoso non è mai sul cromosoma Y. Se è presente, sarà sul cromosoma X.)
- La femmina (X + X difettosa ) è una portante, ma non ha emofilia. Il cromosoma X “buono” consente la produzione di un fattore di coagulazione sufficiente a prevenire gravi problemi di sanguinamento.
- Male (Y + X difettoso ) svilupperà l’emofilia e può trasmetterlo.
Se il padre ha emofilia e la madre non ha gene difettoso (non è un portatore):
Padre (Y + X difettoso ). Madre (X + X).
- Non c’è rischio di emofilia ereditaria nei loro figli perché i maschi erediteranno il loro cromosoma X dalla madre, non dal padre (ereditano solo il cromosoma Y del padre, che non ha il gene difettoso).
- Tutte le figlie saranno portatrici ma non svilupperanno l’emofilia anche se erediteranno il cromosoma X del padre, che ha il gene difettoso. Tuttavia, il loro cromosoma X materno, che non ha il gene difettoso, di solito consente la produzione di un fattore di coagulazione sufficiente a prevenire gravi problemi di sanguinamento.
Se il padre non ha emofilia e la madre ha un gene difettoso:
Padre (Y + X). Madre (X + X difettosa ).
- C’è una probabilità del 50% che i figli sviluppino l’emofilia perché:
- C’è il 50% di rischio che un figlio erediti il cromosoma X difettoso della madre , più il cromosoma Y di suo padre – avrà emofilia.
- C’è una probabilità del 50% che erediterà il cromosoma X “buono” di sua madre, oltre al cromosoma Y di suo padre – non avrà emofilia.
- C’è una probabilità del 50% che le figlie siano portatrici, (ma nessuna possibilità di sviluppare l’emofilia), perché:
- C’è una probabilità del 50% che erediterà il cromosoma X difettoso di sua madre , rendendola una portante.
- C’è una probabilità del 50% che erediterà il cromosoma X “buono” di sua madre, il che significherebbe che non sarebbe una portatrice.
Circa un terzo dei pazienti con emofilia non ha storia familiare della malattia, sia a causa di nuove mutazioni genetiche, sia perché le precedenti generazioni affette hanno avuto figlie (che erano portatrici) o figli che sono morti nella prima infanzia dall’emofilia o da qualsiasi altra causa o che non sono stati colpiti
Cos’è la coagulazione ?
La coagulazione è un processo complesso mediante il quale il sangue forma coaguli per bloccare e quindi guarire una lesione / ferita / taglio e fermare l’emorragia. È una parte cruciale dell’emostasi: l’arresto della perdita di sangue dai vasi sanguigni danneggiati. Nell’emostasi, una parete danneggiata dei vasi sanguigni viene ostruita da una piastrina e da un coagulo contenente fibrina per arrestare il sanguinamento, in modo che il danno possa essere riparato.
La coagulazione coinvolge un componente cellulare (piastrinico) e proteico (fattore di coagulazione).
Quando il rivestimento di un vaso sanguigno (endotelio) viene danneggiato, le piastrine formano immediatamente una spina nel sito della lesione, mentre allo stesso tempo le proteine nel plasma sanguigno reagiscono in una reazione chimica complessa, piuttosto come una cascata, per formare la fibrina fili che rinforzano il tappo piastrinico.
Emostasi primarie – quando le piastrine si riuniscono sul sito di una lesione alla spina (blocco).
Emostasi secondaria: le proteine (fattori di coagulazione) agiscono in una serie di reazioni chimiche per rafforzare la spina e consentire la guarigione.
Cos’è una piastrina?
Una piastrina è un elemento a forma di disco nel sangue che è coinvolto nella coagulazione del sangue. Si aggregano (si raggruppano insieme) durante la normale coagulazione del sangue. Sono classificate come cellule del sangue, ma sono in realtà frammenti di grandi cellule del midollo osseo chiamate megacariociti.
Cos’è la fibrina?
La fibrina è una proteina insolubile coinvolta nella coagulazione del sangue. La fibrina si deposita intorno alla ferita in una forma di rete per rafforzare il tappo piastrinico. L’intera cosa si asciuga e si indurisce (coagula) in modo che l’emorragia si fermi e la ferita guarisca. La fibrina è sviluppata nel sangue da una proteina solubile, fibrinogeno.
Quando le piastrine vengono a contatto con tessuto danneggiato, la trombina si forma come risultato di una serie di processi chimici (coagulazione a cascata) che culminano nella formazione di fibrina da fibrinogeno.
Fattori di coagulazione (fattori di coagulazione)
I fattori di coagulazione sono proteine, per lo più prodotte dal fegato. Originariamente erano numerati nell’ordine della loro scoperta, usando tradizionalmente numeri romani da I-XIII. Alcuni dei numeri come III e VI non sono più utilizzati e negli ultimi anni sono state scoperte molte proteine che influenzano la coagulazione del sangue, ma è stato dato un nome piuttosto che un numero. Quando una parete dei vasi sanguigni viene danneggiata o si verifica un qualsiasi tipo di ferita, si verifica un complesso insieme di reazioni chimiche che coinvolgono questi fattori della coagulazione (e che agiscono piuttosto come una cascata).
Il passaggio finale della cascata di reazioni chimiche consiste nel convertire il fibrinogeno – Fattore I – in fibrina, formando una maglia che aggrega piastrine e cellule del sangue in un coagulo solido, tappando il foro e fermando il sanguinamento. I pazienti con emofilia A hanno livelli di fattore VIII carenti, mentre i pazienti con emofilia B hanno livelli di fattore IX carenti.
Quali sono i sintomi dell’emofilia?
I sintomi dell’emofilia variano a seconda del grado di carenza del fattore di coagulazione (fattore di coagulazione) e dipendono anche dalla natura di eventuali lesioni.
Vengono riconosciuti tre livelli di emofilia, in base al livello degli importi del fattore di coagulazione nel sangue. Questi sono spesso espressi come percentuali del normale:
- Superiore al 5% – lieve emofilia
- 1% al 5% – emofilia moderata
- Meno dell’1% – emofilia grave
Lieve emofilia
Le persone con emofilia lieve ereditaria possono non presentare alcun sintomo fino a quando si verifica un evento che ferisce la pelle o il tessuto, come una procedura od un intervento chirurgico, e provoca un sanguinamento prolungato. Nelle società in cui la circoncisione maschile viene effettuata subito dopo la nascita, l’emofilia lieve verrà individuata prima. Il sanguinamento articolare è raro.
Emofilia moderata
Quelli con emofilia moderata ereditaria saranno visibili all’inizio. Il bambino si schiarisce facilmente e può anche manifestare sintomi interni di sanguinamento, specialmente intorno alle articolazioni e dopo un colpo o una caduta. Il sanguinamento che si verifica all’interno di un’articolazione viene in genere definito come emorragia articolare .
Sintomi di un’emorragia articolare:
- Sensazione di formicolio nell’articolazione
- Dolore nell’articolazione
- Irritazione nell’articolazione
Se non viene trattato, il paziente può eventualmente sperimentare:
- Dolore più grave nell’articolazione
- Rigidità articolare
- L’area interessata diventa gonfia, tenera e calda
Le emorragie articolari colpiscono più comunemente:
-
- caviglie
- ginocchia
- gomiti
… e possono influenzare meno comunemente spalle, fianchi o altre articolazioni.Qualsiasi intervento chirurgico, circoncisione, procedura odontoiatrica o lesioni provocheranno un sanguinamento prolungato in una persona affetta da emofilia.
Emofilia grave
I sintomi sono simili a quelli riscontrati nell’emofilia moderata, ma si verificano più frequentemente e di solito sono più gravi.
Un bambino con emofilia grave spesso sanguina senza motivo apparente, spesso indicato come sanguinamento spontaneo. Più comunemente, nella prima infanzia a partire dai 18 mesi di età, il naso o la bocca iniziano a sanguinare o appaiono apparentemente lividi spontanei, in particolare sulle gambe. Talvolta si sospetta che i genitori causino lesioni non intenzionali (danni intenzionali) ai loro figli.
I sintomi del sanguinamento di tipo emofilia possono includere:
- Diversi lividi grandi o profondi
- Dolore o gonfiore alle articolazioni
- Sanguinamento o lividi inspiegabili
- Sangue nelle feci (sgabelli)
- Sangue nelle urine
- Sangue dal naso inspiegabile
- Sanguinamento di gomma inspiegabile
- Tenuta alle articolazioni
Emorragia intracranica (sanguinamento all’interno del cranio)
Circa 1 su ogni 30 pazienti con emofilia avrà emorragia intracranica almeno una volta durante la loro vita. Questo dovrebbe essere trattato come un’emergenza medica. L’emorragia intracranica spontanea è rara e in molti casi il sanguinamento all’interno del cranio sarà il risultato di un colpo alla testa.
I sintomi di emorragia intracranica includono:
- Un brutto mal di testa
- vomito
- Confusione
- Raccordo (Convulsione)
- Perdita di equilibrio
- Discorso impacciato o altre difficoltà di pronuncia
- Torcicollo
- Problemi di visione
- Perdita di coordinamento
- Alcuni muscoli facciali non funzionano (a volte tutti)
Come viene diagnosticata l’emofilia?
Test prenatali : se una donna incinta ha una storia di emofilia, un test del gene dell’emofilia può essere fatto durante la gravidanza. Un campione di placenta viene rimosso dall’utero e testato. Questo test è noto come test CVS (test dei villi coriali).
Esame del sangue – se un medico sospetta che un bambino possa avere l’emofilia, un esame del sangue può determinare se il paziente ha emofilia A o B e quanto è grave. Le analisi del sangue possono essere eseguite dal momento della nascita in poi.
Fino a qualche decennio fa una percentuale considerevole di pazienti con emofilia moriva prematuramente a causa dell’emofilia. Tragicamente, molte morti sono state il risultato di lesioni o interventi chirurgici dell’infanzia. Negli ultimi quarant’anni il trattamento è avanzato così tanto che oggi si prevede che la stragrande maggioranza dei pazienti vivrà una vita lunga e attiva.
Il principale passo avanti nel trattamento si è verificato quando le deficienze del fattore di coagulazione legate all’emofilia potevano essere identificate e quindi sostituite utilizzando prodotti derivati dal sangue umano.
In passato i pazienti erano soliti ricevere infusioni di sangue o plasma per controllare gli episodi di sanguinamento. Anche se questo ha aiutato, i livelli dei fattori di coagulazione, in particolare i fattori VIII e IX, non hanno mai raggiunto i livelli richiesti per una coagulazione del sangue veramente efficace, né questi livelli potrebbero essere sostenuti – in altre parole, il sanguinamento grave è stato solo parzialmente trattato.
Il crioprecipitato, ottenuto attraverso la precipitazione fredda di plasma congelato dal 1965 in poi, fu il primo trattamento veramente efficace per l’emofilia A. I concentrati liofilizzati ottenuti da plasma umano contenente i giusti livelli di Fattori VIII e IX divennero disponibili alla fine degli anni ’60 e all’inizio degli anni ’70. Essere in grado di mantenere il trattamento a casa e usarlo come richiesto significava che i pazienti potevano viaggiare, uscire da casa, andare al lavoro e godere di un livello di indipendenza. Tuttavia, un gran numero di pazienti successivamente è stato infettato da patogeni trasmissibili per via ematica, come epatite B, epatite C e HIV.
Dalla metà degli anni ’80 la rigorosa selezione dei donatori e le procedure di inattivazione virale hanno ridotto il rischio di trasmissione virale trasmessa per via ematica a quasi zero. Durante gli anni ’90 è diventato possibile preparare fattori sintetici (ricombinanti), usando cellule di mammifero appositamente preparate e questi concentrati ricombinanti sono ora ampiamente usati.
Il trattamento dell’emofilia dipenderà principalmente dalla sua gravità e per i pazienti con emofilia A o B comporta la terapia di sostituzione del fattore di coagulazione. Ci sono due approcci:
- A richiesta – dare un trattamento per fermare il sanguinamento prolungato quando si verifica. Questo è più comune nella gestione dei pazienti con emofilia lieve.
- Trattamento preventivo (profilassi) – farmaci per prevenire episodi emorragici e complicanze successive, come danni articolari e / o muscolari. Più comunemente usato per pazienti con emofilia moderata o grave.
Concentrati di fattore di coagulazione
I concentrati di fattore di coagulazione possono essere realizzati in due modi diversi:
- Fattori di coagulazione derivati dal plasma – preparati dal plasma di sangue umano donato.
- Fattori di coagulazione ricombinanti– la prima generazione di prodotti ricombinanti utilizza prodotti animali nel terreno di coltura e ha aggiunto albumina umana (un prodotto di sangue umano) come stabilizzante. I prodotti di seconda generazione utilizzano materiali di derivazione animale nel terreno di coltura, ma non hanno aggiunta di albumina e usano invece saccarosio o altro materiale non derivato dall’uomo come stabilizzante. I fattori di coagulazione di terza generazione non hanno albumina presente in nessuna fase della loro preparazione. Gli anticorpi monoclonali di topo sono stati abitualmente utilizzati nella purificazione dei fattori della coagulazione per molti anni, ma un fattore VIII ricombinante recentemente autorizzato impiega un ligando sintetico per questa fase. Ciò ha portato alla produzione del primo concentrato di fattore VIII privo di tutte le proteine umane e animali esogene,
Desmopressina (DDAVP) (per emofilia lieve A)
Questo farmaco è un ormone sintetico che incoraggia l’organismo a produrre più del suo proprio Fattore VIII. Non è adatto per i pazienti con emofilia B e quelli con emofilia grave A. Nei pazienti con forme più lievi di emofilia A, può essere necessaria la terapia sostitutiva con fattore VIII, in particolare per sanguinamenti gravi o dopo lesioni gravi o interventi chirurgici importanti.
RISO ( R est, I ce, C ompression, E levation)
Il RISO è un trattamento che molti operatori sanitari raccomandano per i sanguinamenti articolari. Riduce anche il gonfiore e il danno tissutale se usato insieme a concentrati di fattore di coagulazione.
Amministrazione dei concentrati del fattore di coagulazione
Il farmaco viene iniettato in una vena – generalmente nel dorso della mano o nell’incavo del gomito. I trattamenti iniziali sono di solito somministrati da un medico o un infermiere in un ospedale o in una clinica. La maggior parte degli adulti può imparare come fare da sé, il che significa che possono fermare il sanguinamento rapidamente ed efficace ovunque si trovino.
Se il paziente è un bambino, i genitori o gli operatori sanitari (Regno Unito / Irlanda / Australia: accompagnatori) possono imparare come amministrare il trattamento. La maggior parte dei pazienti molto giovani può ricevere la maggior parte del trattamento a casa.
Se un paziente ha difficoltà ad accedere a una vena adatta, o se è necessario un trattamento intensivo, un catetere port-a-cath o un catetere esterno chiamato broviac o Hickman può essere inserito chirurgicamente in una vena, consentendo alle terapie di sostituzione dei fattori di essere dato, e il sangue da disegnare facilmente per i test di emergenza di routine. L’uso di tali cateteri può essere complicato da infezioni e blocchi e devono essere usati con molta cura.
Trattare sanguinamenti
Episodi di sanguinamento (sanguinamenti) sono una complicazione inevitabile per i pazienti con emofilia A e B, anche per i pazienti con forme lievi. Poiché il problema di fondo è quello di un’emorragia prolungata, piuttosto che un rapido sanguinamento, spesso non sembrano essere emergenze mediche.
Se una persona affetta da emofilia presenta una delle seguenti condizioni, deve cercare un aiuto medico immediato e qualificato:
- C’è una ferita al collo, alla bocca, alla lingua, al viso o agli occhi.
- C’è un grave colpo alla testa.
- Il sanguinamento è pesante o persistente.
- Vi è un forte dolore o gonfiore in qualsiasi parte del corpo.
- Una ferita aperta richiede una cucitura.
La maggior parte degli altri sanguinamenti, come emorragie articolari / muscolari, piccole ferite e tagli che non richiedono punti di sutura, e sangue dal naso sono generalmente curati a casa, ma i pazienti dovrebbero sempre chiedere il parere di un operatore sanitario in caso di dubbio. Qualsiasi trattamento sarà più efficace se avviato in anticipo.
Conservazione del trattamento
I concentrati del fattore devono essere normalmente conservati in frigorifero ma sono stabili a temperatura ambiente per periodi piuttosto lunghi. Non dovrebbero essere congelati in quanto ciò potrebbe danneggiare le fiale o le siringhe. Alcuni possono essere portati fuori per viaggiare, ma dovrebbero idealmente essere tenuti in una borsa fresca. Leggi le istruzioni sulla conservazione del prodotto. In caso di dubbi, consultare un medico o un farmacista qualificato.
inibitori
Circa il 30% delle persone con emofilia grave A sviluppa anticorpi contro il fattore VIII trasfuso, di solito poco dopo i primi trattamenti. Questi anticorpi (chiamati anche inibitori) impediscono il corretto funzionamento del fattore VIIII. Spesso accade che, dopo un po ‘, gli inibitori scompaiano e solo circa il 10% o meno delle persone con grave emofilia A soffriranno di inibitori a lungo termine. Negli ultimi anni è diventato possibile impedire agli inibitori di diventare persistenti attraverso la terapia di induzione della tolleranza immunitaria. Dove gli inibitori non rispondono a questo approccio sono disponibili trattamenti alternativi.
Gli inibitori si sviluppano raramente in lieve emofilia A o in emofilia B di qualsiasi gravità.