Un nuovo studio trova un modo per migliorare la risposta antitumorale del sistema immunitario.
I trattamenti contro il cancro sono in continua evoluzione; uno dei cambiamenti più recenti nel trattamento ruota intorno al miglioramento della risposta immunitaria naturale.
Il nostro sistema immunitario è eccellente per distruggere e rimuovere cellule danneggiate, difettose o vecchie, ma nel caso del cancro, tende ad avere bisogno di un piccolo aiuto.
Le immunotopie sono progettate per stimolare il sistema immunitario di un paziente per combattere il cancro all’interno. Sebbene le ultime immunoterapie possano essere efficaci, funzionano solo per la minoranza di pazienti con tumori solidi.
La gara è in corso per migliorare questi metodi e farli funzionare per una gamma più ampia di pazienti. Coinvolto in questa spinta è un gruppo di Ecole Polytechnique Federale de Lausanne (EPFL), Svizzera.
Vaccini con cellule dendritiche
Nello specifico, il gruppo svizzero è interessato a migliorare i cosiddetti vaccini a cellule dendritiche. Le cellule dendritiche, dette anche cellule presentanti l’antigene, sono una parte importante del sistema immunitario. Catturano antigeni da corpi estranei e li consegnano a cellule T killer, che quindi neutralizzano la minaccia.
Per creare i vaccini a cellule dendritiche, le cellule dendritiche vengono rimosse dal paziente e dagli antigeni tumorali “alimentati forzatamente” prima di essere rilasciate nuovamente nel paziente. In questo modo, le cellule T killer sono innescate per distruggere le cellule tumorali, che sono normalmente esperti nell’eludere il sistema immunitario.
I vaccini contro le cellule dendritiche hanno già mostrato risultati promettenti, ma hanno dei limiti. Uno dei principali inconvenienti è che gli antigeni tumorali usati per “nutrire” le cellule dendritiche provengono da tumori cresciuti in laboratorio, non da quelli del paziente. Poiché ciascun tumore è diverso, il vaccino non è esattamente abbinato e, pertanto, può essere attivato solo parzialmente dal tumore residente.
Un nuovo progresso
I ricercatori dell’EPFL, guidati dal prof. Michele De Palma, hanno tentato in qualche modo di risolvere questo problema.
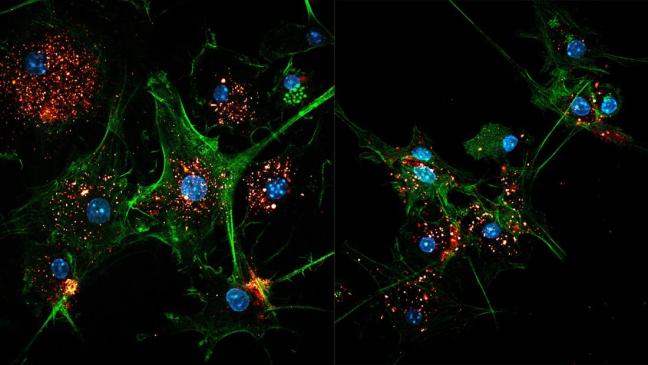
Due immagini di cellule dendritiche progettate da EVIR (verde) che catturano antigeni tumorali in esosomi (oro / rosso). I nuclei delle cellule sono blu.
Immagine di credito: C. Cianciaruso / M. De Palma / EPFL
Hanno creato recettori artificiali, noti come recettori per l’internalizzazione delle vescicole extracellulari (EVIR).
Le cellule dendritiche vengono estratte da un paziente e gli EVIR vengono inseriti in essi.
Quando le cellule dendritiche vengono restituite al corpo del paziente, sono predisposte a riconoscere i tipi di piccola vescicola chiamati esosomi .
Gli esosomi sono piccoli pacchetti che trasportano varie molecole tra le cellule; importanti in una serie di processi, come la coagulazione, la segnalazione cellulare e la gestione dei rifiuti, sono prodotti da tumori in grandi quantità. Nelle cellule tumorali, si pensa che giochino un ruolo nelle metastasi, aiutando il cancro a raggiungere e prosperare in parti distanti del corpo.
Gli EVIR intrappolano gli esosomi viaggiando attraverso il corpo, dando alle cellule dendritiche il modello esatto del tumore residente. Le cellule dendritiche possono quindi informare le cellule T killer e aumentare la risposta immunitaria del paziente al cancro.
Utilizzando tecniche di imaging, il team ha dimostrato che gli EVIR hanno migliorato il trasferimento degli antigeni tumorali dall’esosoma alla membrana esterna della cellula dendritica.
I loro risultati sono pubblicati questa settimana sulla rivista Nature Methods .
“Chiamiamo questo fenomeno di cross-dressing, che allude al fatto che le cellule dendritiche acquisiscono antigeni immunogenici dal tumore e li mostrano direttamente sulla loro superficie.Questa è una strada affascinante e non convenzionale per la presentazione dell’antigene alle cellule T, che non richiedono interazioni molecolari complesse e limitanti la velocità all’interno della cellula dendritica. ”
Prof. Michele De Palma
Il team spera che questa nuova tecnologia possa finalmente migliorare la specificità e il potere di uccisione dell’immunoterapia. Mario Leonardo Squadrito, primo autore dello studio, spiega:
“La tecnologia EVIR può intercettare un fenomeno naturale – il rilascio di esosomi dai tumori – a beneficio del paziente, che sfrutta gli esosomi pro-tumorali come nanocarrier selettivi di antigeni tumorali, rendendoli disponibili al sistema immunitario per il riconoscimento e il rigetto del cancro.”
Prima che questa tecnologia rivoluzionaria possa essere utilizzata nei pazienti, avrà bisogno di più studi. Gli autori stanno progettando di continuare questa linea di ricerca con gli scienziati dell’ospedale universitario CHUV di Losanna.